
EQUILIBRIO QUÍMICO:
EQUILIBRIO QUÍMICO=>VELOCIDAD:
aA + bB <=> cC + dD
reactivos y productos con una misma velocidad, si no la reacciión no es reversible, no habrá equilibrio
¿Cómo funciona el equilibrio?
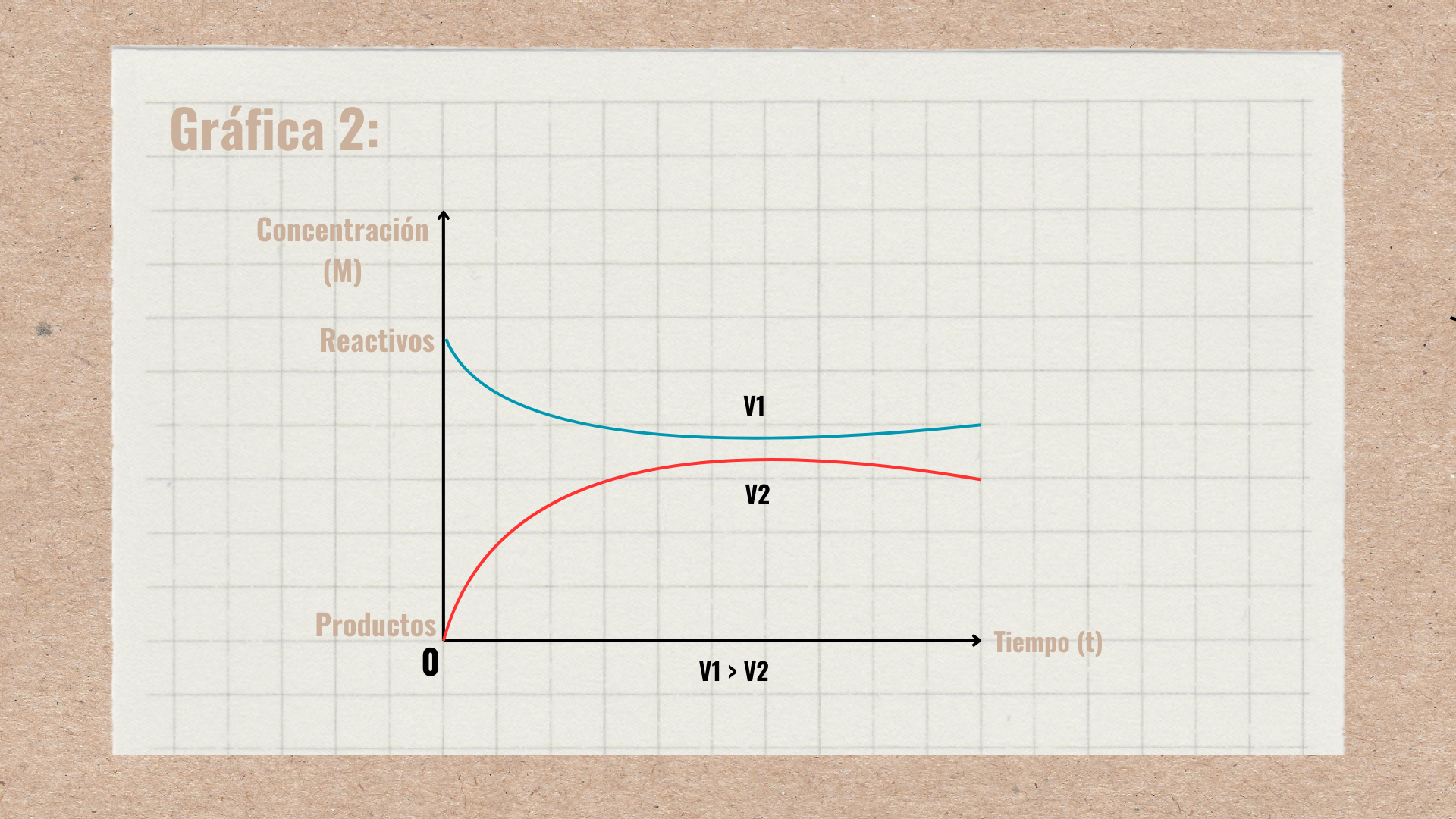
Cando A y B resccionan para formar C y D con la misma velocidad que C y D reaccionan para formar A y B el sistema se encuentra en equilibrio químico.
Se grafíca a través de un plano cartesiano:
Gráficas:
Se pueden representar en tres gráficas diferentes:


Constante de Equilibrio:
aA + Bb <=> cC + dD
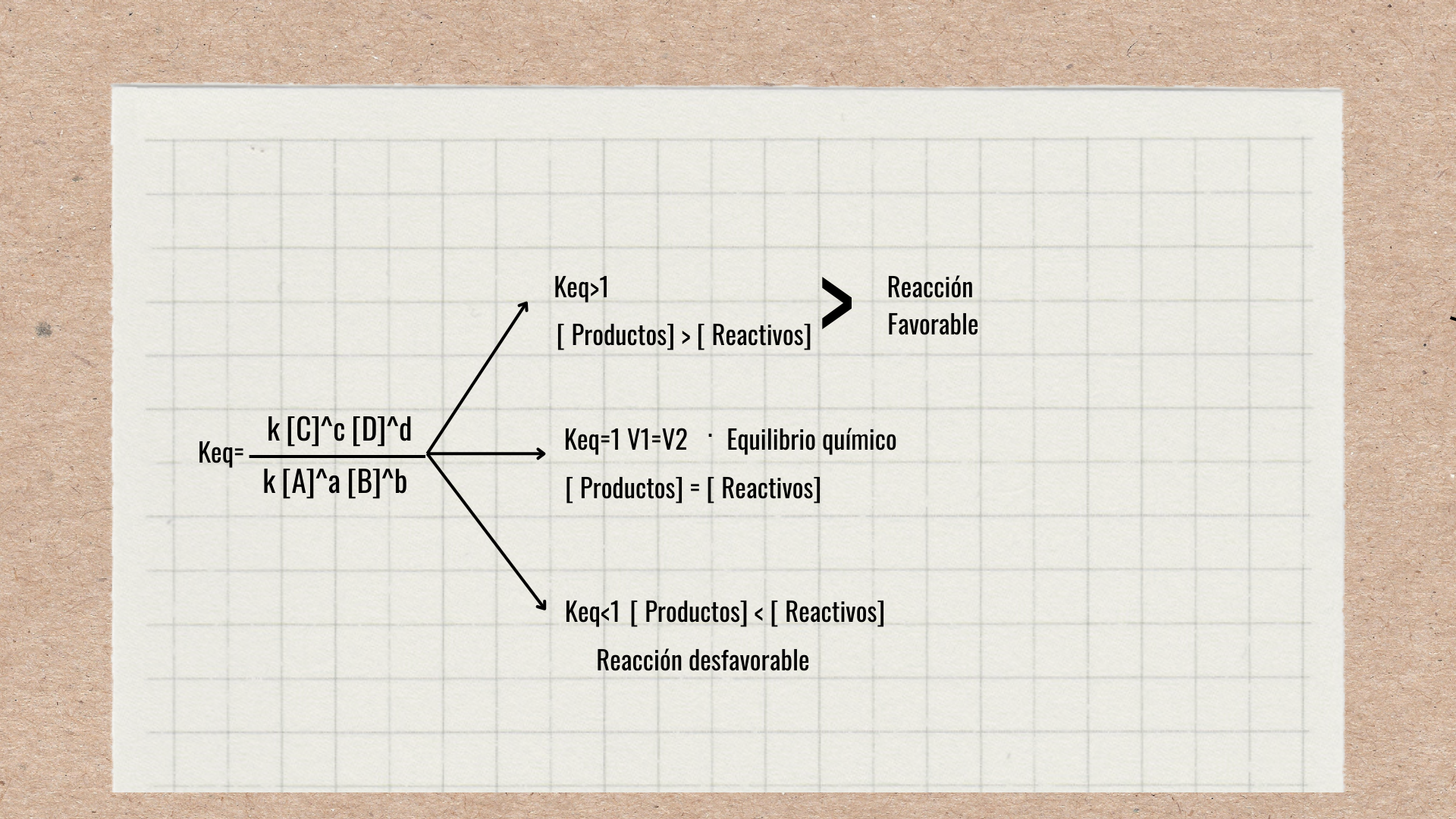
Matematicamente, la constante de equilibrio se expresa en función de la velocidad y las concentraciones
V1=k [A]^a [B]^b / V2=k [C]^c [D]^d
V1=V2
k [A]^a [B]^b / k [C]^c [D]^d
Formúla de constante de equilibrio:

Tres Situaciones:

TIPOS DE EQUILIBRIO:
HOMOGÉNEO:
Los reactivos y productos se encuentran en el mismo estado de agregación
N2O4(g) <=> 2NO2(g)
Keq= [NO2]^2/[N2O4]
La concentración de sólidos y líquidos puros. No se consideran en la expresión para la constante de equilibrio (Ambos)
HETEROGÉNEO:
Los reactivos y productos se encuentran en diferentes estado de agregación
CaCO3(s) <=> CaO(s) + CO2(g)
Keq= [CO2]

FACTORES QUE AFECTAN EL EQUILIBRIO QUÍMICO
TEMPERATURA, PRESIÓN Y CONCENTRACIÓN:
Si en un sistema se modifica alguno de los factores, el sistema evoluciona de forma que se desplaza en el sentido que tienda a contrarestar dicha variación.
CONCENTRACIÓN:
Cuando la concentración de reactivos es mayor, irá a la derecha y cuando la de los productos es mayor irá a la izquierda
TEMPERATURA:
Está relacionada con el caracter endotérmico y exotérmico de una reacción. En una reacción endotérmica a mayotr temperatura se desplaza a productos y a menor temperatura se des´plaza a reactivos.
PRESIÓN:
Solo estado gaseos, solo si hay variaciones de moles, a mayor presión menos moles y desplazamiento a la derecha, y a menor presión más moles y desplazamiento a la izquierda.